Geometria molecular
Geometria molecular é o formato que uma molécula assume no espaço em virtude do posicionamento de seus átomos em torno de um átomo central.
Geometria molecular é o formato adotado por uma molécula constituída por ligação covalente no plano espacial. Essa forma baseia-se na maneira como os átomos que compõem a molécula, que deve apresentar mais de dois átomos, estão dispostos em torno do átomo central.
A disposição dos átomos em uma molécula está baseada na teoria da repulsão de pares eletrônicos (TREPV), que afirma que os elétrons presentes nas nuvens eletrônicas ao redor de um átomo central repelem-se (afastam-se), alterando o posicionamento dos átomos, determinando, assim, a geometria molecular.
Obs.: Nuvem eletrônica é o par de elétrons formado por uma ligação entre dois átomos ou entre elétrons da camada de valência do átomo central que não estejam participando de uma ligação química.
Geometria linear, angular, trigonal plana, tetraédrica, bipiramidal, octaédrica são exemplos de geometrias moleculares. Para facilitar a determinação da geometria das moléculas de uma substância, o químico inglês Ronald James Gillespie criou, em 1954, algumas regras baseadas na TREPV, que serão descritas abaixo.
1- Geometria linear
Essa geometria molecular ocorre quando há uma molécula diatômica (dois átomos) ou triatômica (três átomos) na qual o átomo central está ligado diretamente a outros dois átomos. No caso da molécula triatômica, não há nuvem eletrônica não ligante.
Exemplo 1: Iodo (I2)
Exemplo 2: Dissulfeto de carbono (CS2)
Na molécula do CS2, há três átomos: um átomo de carbono ligado a dois átomos de enxofre. Nessa estrutura, todos os quatro elétrons da camada de valência do carbono estão participando das ligações químicas.
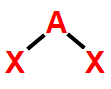
2- Geometria angular
Essa geometria molecular ocorre quando há uma molécula triatômica (três átomos) cujo átomo central liga-se diretamente a dois outros átomos. Essa ligação apresenta, obrigatoriamente, uma ou duas nuvens eletrônicas não ligantes.
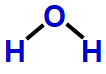
Exemplo: Água (H2O)
Na molécula de H2O , há três átomos: um átomo de oxigênio ligado a dois átomos de hidrogênio. Nessa formação, apenas dois dos seis elétrons da camada de valência do oxigênio estão participando das ligações químicas. Logo, há duas nuvens não ligantes.
3- Geometria trigonal plana
Essa geometria molecular ocorre quando se tem uma molécula tetratômica (quatro átomos) na qual o átomo central liga-se diretamente a três outros átomos. Nessa estrutura, não há nuvem eletrônica não ligante.
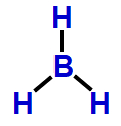
Exemplo: Tri-hidreto de boro (BH3)
Não pare agora... Tem mais depois da publicidade ;)
A molécula do BH3 é formada por quatro átomos: um átomo de boro ligado a três átomos de hidrogênio. Nessa molécula, todos os três elétrons da camada de valência do boro estão participando das ligações químicas.
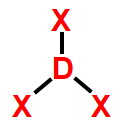
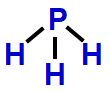
4- Geometria piramidal
Essa geometria molecular ocorre quando há uma molécula tetratômica (quatro átomos) cujo átomo central liga-se diretamente a três outros átomos. Essa estrutura apresenta, obrigatoriamente, uma nuvem eletrônica não ligante.
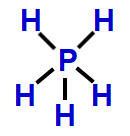
Exemplo: Hidreto de fósforo (PH3)
Na molécula do PH3, há quatro átomos: um átomo de fósforo ligado a três átomos de hidrogênio. Nessa formação, apenas três dos cinco elétrons da camada de valência do fósforo estão participando das ligações químicas. Logo, há uma nuvem não ligante.
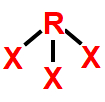
5- Geometria tetraédrica
Essa geometria molecular ocorre quando há uma molécula pentatômica (cinco átomos) cujo átomo central, que não apresenta nuvem eletrônica não ligante, liga-se diretamente a quatro outros átomos.
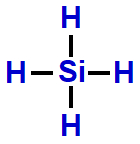
Exemplo: Tetra-hidreto de silício (SiH4)
Na molécula do SiH4, há cinco átomos: um átomo de silício ligado a quatro átomos de hidrogênio. Todos os quatro elétrons da camada de valência do silício estão participando das ligações químicas.
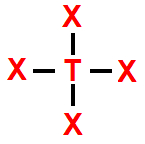
6- Geometria bipiramidal
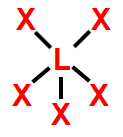
Essa geometria molecular ocorre quando há uma molécula hexatômica (seis átomos) cujo átomo central liga-se diretamente a cinco outros átomos. Nesse caso, não há nuvem eletrônica não ligante.
Exemplo: Penta-hidreto de fósforo (PH5)
Na molécula do PH5, há seis átomos: um átomo de fósforo ligado a cinco átomos de hidrogênio. Todos os cinco elétrons da camada de valência do fósforo estão participando das ligações químicas.
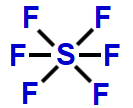
7- Geometria octaédrica
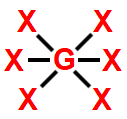
Essa geometria molecular ocorre quando há uma molécula heptatômica (sete átomos) na qual o átomo central liga-se diretamente a seis outros átomos. Nesse caso, não há nuvem eletrônica não ligante.
Exemplo: Hexafluoreto de enxofre (SF6)
Na molécula do SF6, há sete átomos: um átomo de enxofre ligado a seis átomos de flúor. Todos os seis elétrons da camada de valência do enxofre estão participando das ligações químicas.
Por : Diogo Lopes Dias
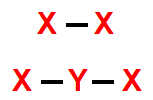
Nenhum comentário:
Postar um comentário