Balanceamento de Equações Químicas
Para o correto balanceamento de equações químicas, o número de átomos de cada elemento nas substâncias reagentes tem de ser igual ao número de átomos desses mesmos elementos nas substâncias obtidas.
Às vezes, ao escrever uma reação, o número de átomos dos reagentes difere do número de átomos dos produtos. Nesse caso, a equação não se encontra balanceada.
Para balancear uma equação química, devem ser atribuídos valores numéricos, escritos à esquerda da fórmula, a cada substância participante. Esses números são denominados coeficientes estequiométricos.
O balanceamento da equação pode ser feito por dois métodos.
Balanceamento por tentativas
Como seu próprio nome indica, trata-se de atribuir coeficientes aos reagentes e aos produtos para que de ambos os lados haja o mesmo número de átomos de cada elemento.
Ao analisar a equação da reação entre zinco e ácido clorídrico, por exemplo:
Zn + HCI → ZnCI2 + H2
pode-se observar que:
- Zn – há um átomo em cada membro da equação; está balanceado.
- H – há um átomo à esquerda e dois à direita; não está balanceado.
- Cl – há um átomo à esquerda e dois à direita; não está balanceado.
Para balancear a reação, colocar-se coeficiente dois no HCI. Dessa forma o H e o Cl ficam balanceados.
A equação balanceada é:
Zn + 2 HCI → ZnCI2 + H2
É importante observar que, ao balancear uma equação química não se modificam as fórmulas das substâncias envolvidas.
Passo a passo
Uma maneira prática de se efetuar o balanceamento por tentativas consiste em colocar coeficiente um na fórmula (molécula, íon) que apresenta o maior número de átomos aglomerados. Com base no coeficiente colocado, procede-se ao acerto dos demais. Exemplo:
C2H6O + O2 → CO2 + H2O
- Atribui-se coeficiente 1 ao C2H6O, porque essa é a substância que apresenta o maior aglomerado de átomos:
1 C2H6O + O2 → CO2 + H2O
- Como do lado esquerdo da reação aparecem 2 átomos de carbono e 6 átomos de hidrogênio e do lado direito aparecem 1 átomo de carbono no CO2 e dois átomos de hidrogênio no H2O, deve-se acertar os coeficientes dessas substâncias:
1 C2H6O + O2 → 2 CO2 + 3 H2O
- Por último, conta-se o número de átomos de oxigênio nos produtos da reação (4 + 3 = 7) e acerta-se o coeficiente do O2 nos reagentes:
1 C2H6O + 3 O2 → 2 CO2 + 3 H2O1 oxigênio + 6 oxigênio = 7 oxigênios
O coeficiente 1 do álcool deve ser omitido.
Método algébrico de balanceamento
No método algébrico de balanceamento, escreve-se a equação química e atribuem-se, a cada substância, coeficientes genéricos. O princípio de conservação do número de átomos de cada elemento proporciona uma equação algébrica para cada um deles.
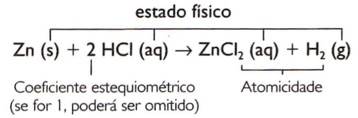
Zn(s) + HCI(aq) → ZnCI2(aq) + H2(g)
O método envolve as seguintes etapas:
- Equação não-balanceada:
Zn(s) + HCI(aq) → ZnCI2(aq) + H2(g)
- Equação com coeficientes genéricos:
a Zn(s) + b HCI(aq) → c ZnCI2(aq) + d H2(g)
- Equações algébricas para cada elemento. Ex: temos a Zn no reagente e c Zn no produto, então Zn: a = c. Faça o mesmo com todos os elementos:
Zn: a = c
Cl: b = 2 c
H: b = 2 d
Cl: b = 2 c
H: b = 2 d
- Atribuição de um valor arbitrário a um dos coeficientes para resolver o sistema de equações. Suponha-se, por exemplo, a = 1. Então, c = 1, b = 2 e d = 1. A equação balanceada fica:
1 Zn(s) + 2 HCI(aq) → 1 ZnCI2(aq) + 1 H2(g)
Como não se usa o coeficiente 1, fica:
Zn(s) + 2 HCI(aq) → ZnCI2(aq) + H2(g)
Exercício resolvido
Balancear a reação: C2H6 + O2 → CO2 + H2O
Deve-se colocar um 2 como coeficiente do CO2 para balancear os carbonos e um 3 como coeficiente do H2O para balancear os hidrogénios.
C2H6 + O2 → 2 CO2 + 3 H2O
Então, para balancear o oxigênio, é necessário atribuir-lhe o coeficiente 7/2.
C2H6 + 7/2 O2 → 2 CO2 + 3 H2O
A fim de balancear a equação usando somente números inteiros, deve-se multiplicar todos os coeficientes por 2:
2 C2H6 + 7 O2 → 4 CO2 + 6 H2O
Por: Paulo Magno Torres
Nenhum comentário:
Postar um comentário