Agora vamos falar sobre algo muito importate na química geral esse é o conteúdo mais estudado no ensino médio...
Distribuição Eletrônica
Nos elementos químicos conhecidos, os átomos podem distribuir-se em 7 níveis de energia (contendo elétrons) que são representados, em sequência, a partir do núcleo, pelas letras K, L, M, N, O, P, Q ou pelos números 1, 2, 3, 4, 5, 6, 7.
Estes números são chamados de números quânticos principais, eles representam a aproximada distância do elétron ao núcleo, como também a energia do elétron. Se um elétron tem número quântico principal igual a 3, ele pertence à camada M e tem a energia desse nível.
.jpg)
Exemplo:
Represente, esquematicamente, o átomo de número atômico 17 e número de massa 35.
Temos: Nº de prótons: Z = 17
Z = 17 Nº de elétrons: Z = 17
A = 35 Nº de nêutrons N = A – Z = 35 – 17 = 18
Z = 17 Nº de elétrons: Z = 17
A = 35 Nº de nêutrons N = A – Z = 35 – 17 = 18
Distribuição eletrônica:
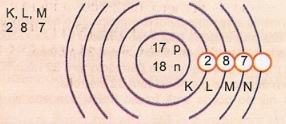
Camada de valência
O nível de energia mais externo do átomo é denominado camada de valência. Assim, no átomo do exemplo anterior é a camada M. Ela pode conter, no máximo, 8 elétrons.
Subníveis de energia
Verificou-se que a radiação correspondente à energia liberada, quando um elétron passa de um nível de energia mais afastado para outro mais próximo do núcleo, é, na realidade, a composição de várias ondas luminosas mais simples. Conclui-se, então, que o elétron percorre o caminho “aos pulinhos’, isto é, os níveis de energia subdividem-se em subníveis de energia.
Nos átomos dos elementos conhecidos, podem ocorrer 4 tipos de subníveis, designados sucessivamente pelas letras s (“sharp”), p (“principal”), d (“diffuse”) e f (“fundamental”).
O número máximo de elétrons distribuído em cada subnível é:
| s | p | d | f |
| 2 | 6 | 10 | 14 |
Nenhum comentário:
Postar um comentário